Il glioblastoma è il tumore più comune e mortale del sistema nervoso centrale negli adulti. Nonostante il protocollo di trattamento standard stabilito nel 2005, che combina la massima chirurgia seguita da sessioni di radioterapia e chemioterapia, i pazienti vivono in media solo 15 mesi dopo la diagnosi. Questa aggressività è particolarmente legata alla presenza di cellule staminali tumorali chiamate cellule staminali del glioblastoma o GSC. Queste cellule, coinvolte nell'innesco, nella crescita e nella recidiva del tumore, rappresentano quindi bersagli preferenziali per lo sviluppo di nuove strategie terapeutiche.
I lisosomi svolgono un ruolo cruciale nel mantenimento delle cellule staminali tumorali
I lisosomi, gli elementi costitutivi della cellula, formano una rete dinamica di vescicole (un tipo di piccole sacche), a pH acido. Coinvolto nel movimento dei materiali all'interno della cellula. Partecipano ai processi metaboliciE Sono responsabili della digestione delle molecole assorbite dalla cellula e della degradazione dei componenti cellulari difettosi.
Lavori precedenti dimostrano che consente anche alle cellule staminali del glioblastoma di sopravvivere al di fuori della loro nicchia protettiva all'interno del tumore. Infatti, i lisosomi amplificano la segnalazione del fattore di crescita e facilitano la proliferazione e la proliferazione delle cellule tumorali. Nelle cellule staminali del glioblastoma, l'alterazione della quantità e della qualità dei lisosomi porta alla morte specifica di queste cellule. I lisosomi sono quindi un bersaglio terapeutico fondamentale per influenzare le decisioni sulla vita e sulla morte di queste cellule staminali di glioblastoma e quindi controllarne la popolazione.
Per destabilizzare la parete delle piccole sacche che sono i lisosomi, situate nel cuore delle cellule staminali del glioblastoma, gli scienziati hanno identificato il ruolo della proteasi MALT1 (della famiglia delle paracaspasi). L'inibizione di questo enzima, recentemente identificato come un importante mediatore dell'omeostasi del lisosoma, provoca la morte lisosoma-dipendente delle cellule staminali del glioblastoma. Ciò avviene attraverso un meccanismo che coinvolge la contrazione delle proteine leganti l'mRNA e la modulazione dell'espressione delle proteine chiave nel compartimento lisosomiale. Tuttavia, i meccanismi d’azione di MALT1 rimangono scarsamente descritti.
Un’ondata di colesterolo lisosomiale distrugge le cellule staminali del glioblastoma
Oggi, i risultati di questo studio forniscono una migliore comprensione di come funziona il sistema. Essi suggeriscono infatti che la soppressione di MALT1, da parte di agenti farmacologici o mediante interferenza dell'RNA (una tecnica che permette di inibire specificamente la sintesi proteica distruggendo il messaggero a cui corrisponde), modula l'omeostasi (l'equilibrio tra le cellule interne). ed esterno) del colesterolo. Il colesterolo si accumula quindi in vescicole nel compartimento lisosomiale e negli endosomi tardivi. Questo mancato apporto di colesterolo porta alla morte cellulare e a difetti dell'autofagia (il sistema di autopulizia della cellula), che possono essere parzialmente invertiti fornendo alle cellule staminali del glioblastoma una membrana permeabile al colesterolo. Questi risultati sono stati ottenuti combinando l'analisi RNA-seq e la quantificazione proteica, eseguita su cellule staminali di glioblastoma derivate dal paziente esposte a un inibitore farmacologico dell'attività proteolitica di MALT1.
Da un punto di vista molecolare, l'analisi mirata della proteina lisosomiale ha rivelato che i trasportatori del colesterolo lisosomiale di tipo Niemann-Pick C (NPC) sono meno presenti quando l'attività MALT1 è inibita. Coerentemente con questi dati, il blocco o il silenziamento dell'espressione dei trasportatori NPC1/2 riproduce farmacologicamente gli effetti della perdita della funzione MALT1, suggerendo un'azione simile per queste due molecole. Infine, l’inibizione di MALT1 o NPC1/2 rallenta la crescita del tumore nei modelli murini immunocompromessi portatori di cellule staminali di glioblastoma derivate dal paziente.
Pertanto, questo lavoro ha consentito la mappatura degli eventi a livello subcellulare, coinvolti nella destabilizzazione lisosomiale indotta dal targeting molecolare e farmacologico della paracaspasi MALT1. Questi dati sollevano l’idea che le proprietà e il mantenimento delle cellule staminali del glioblastoma dipendano dall’omeostasi del colesterolo lisosomiale.
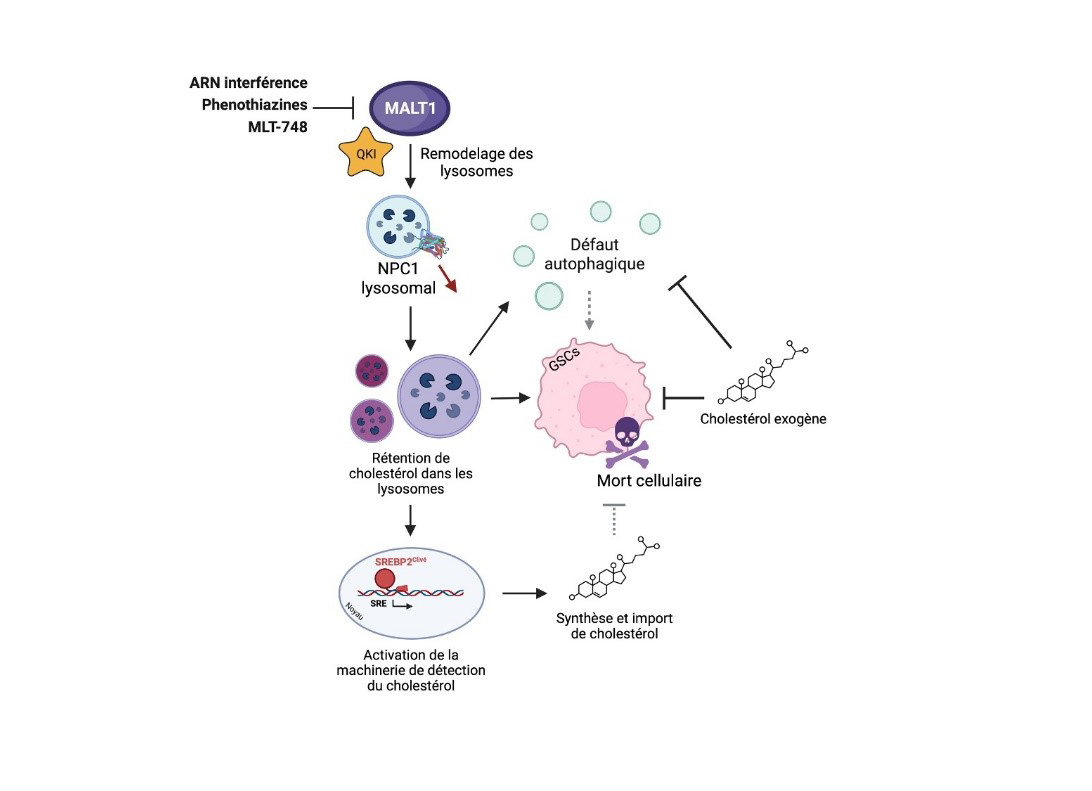
Figura: Modello dell'azione MALT1 nel mantenimento dell'omeostasi lisosomiale
La proteasi MALT1 regola la localizzazione lisosomiale della proteina NPC1 e l'omeostasi del colesterolo. Nelle cellule staminali del glioblastoma (GSC), l'inibizione dell'attività della paracaspasi MALT1 o l'interferenza con il suo livello di espressione porta al rimodellamento del compartimento lisosomiale, in particolare riducendo la quantità del trasportatore del colesterolo NPC1. Segue il sequestro intra-lisosomiale del colesterolo, che porta a un difetto dell’autolisi, all’attivazione del meccanismo che consente l’importazione e la sintesi del colesterolo e infine alla morte cellulare delle cellule staminali tumorali. L'aggiunta di colesterolo esogeno alle CSC in cui l'attività MALT1 è stata inibita contraddice parzialmente i fenotipi sopra menzionati, ponendo così il trasporto lisosomiale del colesterolo come bersaglio per le CSC.
Per saperne di più :
La paracaspasi MALT1 controlla l'omeostasi del colesterolo nelle cellule simili al glioblastoma attraverso la formazione di proteine lisosomiali. Magee C, Trillet K, Andre Gregoire G, Kerhervé M, Merlet L, Jacobs KA, Scheuer K, Bedier N, Gavard G. Rappresentante della cellula. 5 gennaio 2024;43(1):113631. doi: 10.1016/j.celrep.2023.113631.

“Appassionato di alcol. Piantagrane. Introverso. Studente. Amante dei social media. Ninja del web. Fan del bacon. Lettore”.

